Mezcladito - transposones y el Sistema de Expresión Gal4-UAS
Creo que es importante que ampliemos un poco sobre el tema de las herramientas genéticas disponibles en las moscas Drosophila. No solo para saber más sobre estas herramientas, sino también para pensar sobre lo asombroso que es nuestro genoma. El ADN que tenemos en cada célula de nuestro cuerpo no es una molécula fija estática. Está sujeto a cambios. Algunas partes pueden moverse de un lugar a otro y hasta pueden incorporarse nuevos pedazos. La transgénesis es un proceso que se ha producido de forma natural durante millones de años.
También me interesa que lo veamos desde una perspectiva más histórica, para apreciar cómo se aprovechó el poder de descubrimientos en ciencia básica para traducirlos en técnicas y herramientas que revolucionaron el uso de Drosophila como organismo modelo y abrió el camino para décadas de investigación y descubrimientos.
Elementos transponibles - Los Elementos P
En el post sobre moscas transgénicas, no dimos detalles sobre cómo es que se logra que se incorpore al genoma de la mosca el ADN que teníamos en un plásmido (una molécula circular de ADN que se puede replicar en bacterias) . Mencionamos brevemente que esto se logra porque usamos un plásmido al que se le agregaron también unas secuencias de ADN que son reconocidas por una proteína que las cortas para luego llevarse toda la molécula y pegarla en algún lugar del genoma al azar. Esta proteína se llama transposasa porque puede transponer fragmentos de ADN al interior del genoma.
En la década de 1950, Barbara McClintock observó ciertos patrones de pigmentación anómalos en las plantas de maíz. A partir de estos, descubrió que el genoma no es estático y que pedazos del ADN pueden moverse y cambiar de lugar dentro del genoma. Cuando estos fragmentos de ADN se mueven, a veces aterrizan en genes e interrumpen su función, generando mutaciones como la pérdida de la capacidad para producir algunos pigmentos.
Como pueden cambiar de posición en el genoma, estas secuencias se denominan elementos transponibles o transposones (el trabajo de McClintock pasó desapercibido y no tuvo la debida repercusión en el momento de su publicación; en las décadas siguientes fue redescubierto y mucho más tarde le otorgaron el Premio Nobel).
Es más, hemos mencionado que gran parte del ADN en nuestros genomas no contiene genes propiamente dichos. Una gran parte de todo ese ADN extra en todas las células de nuestro cuerpo son restos de elementos que se movieron y fueron dejaron pedazos y rastros tras de sí a través de los millones de años de evolución. ¡Nuestros genomas son un verdadero collage de ADN!
Más tarde, se descubrió que estos elementos de ADN son secuencias específicas que usan diferentes mecanismos para moverse por el genoma.
Algunos de ellos se mueven en dos pasos; primero se transcriben de ADN a ARN (como ya aprendimos) y segundo ese ARN es convertido en ADN (por un proceso llamado retrotranscripción) para finalmente ser insertado en algún lugar del genoma (los virus como el VIH funcionan de esta manera).
Otros se mueven de lugar por medio del cortado del ADN directamente desde el genoma para luego transportarlo e insertarlo en otra parte, en un proceso mediado por la transposasa.
Algunos elementos son autónomos y su movimiento se llevan a cabo por medio de proteínas codificadas dentro mismo de los elementos. ¡Pueden moverse por cuenta propia!
En los años sesenta y setenta, los elementos transponibles se estudiaron intensamente y se los encontró presentes en muchos organismos. A fines de la década de 1970 y principios de la década de 1980, se propuso que elementos transponibles podían explicar ciertas mutaciones inesperadas que se observaban en moscas de Drosophila. Esto condujo al descubrimiento de elementos transponibles llamados elementos P.
Los elementos transponibles que se encontraron (los elementos P) consistían en un gen que codifica para producir una proteína transposasa. En ambos extremos de este gen se encuentran las secuencias a las que la transposasa se puede unir y luego cortar, para extraer del genoma la secuencia completa (incluido el gen de la transposasa) e insertarla en otro lugar.
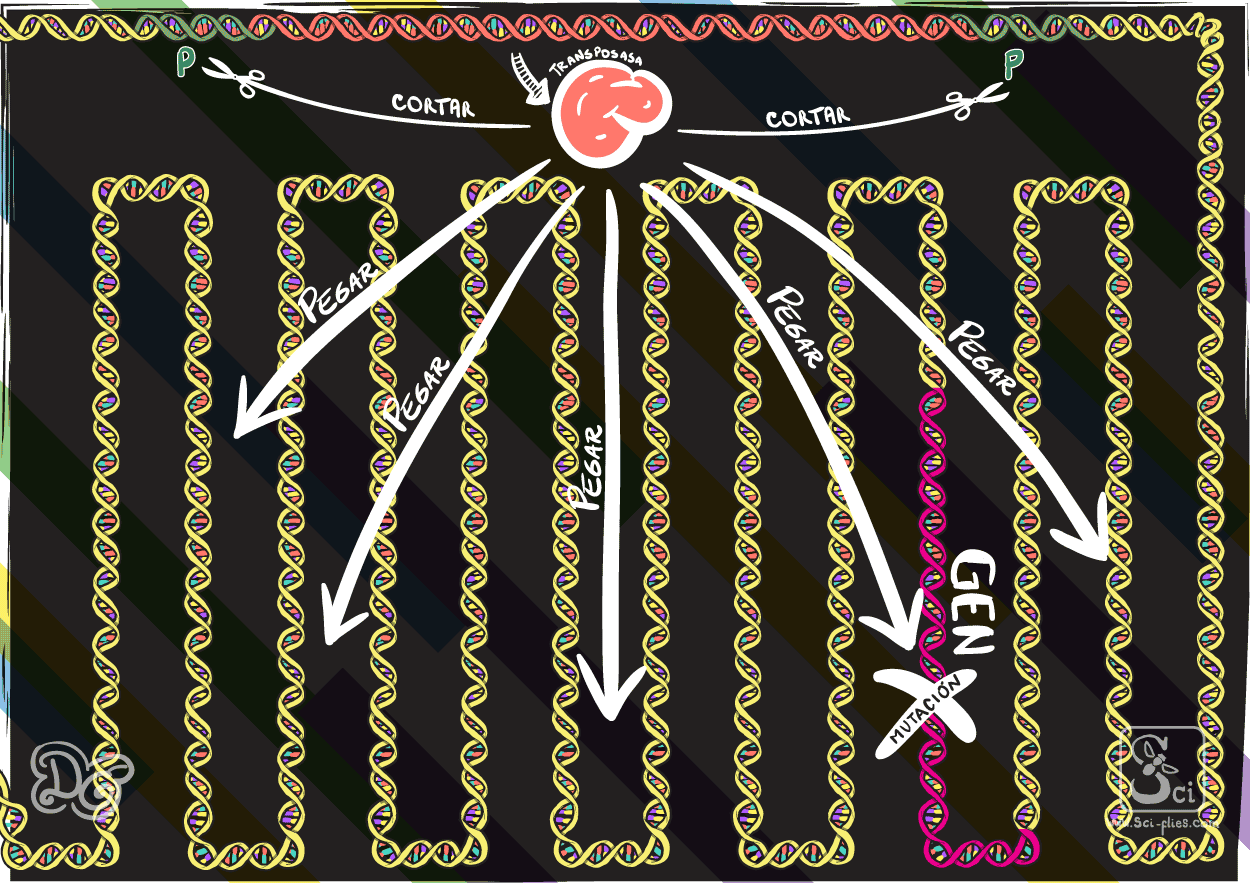
En 1982, Gerald Rubin y Allan Spradling inyectaron estos elementos P en embriones de líneas de moscas que normalmente no los tenían y demostraron que en las próximas generaciones esos elementos se incorporaban y se movían por el genoma.
Se dieron cuenta de que podían usar estos elementos que se encontraban naturalmente en las moscas para insertar cualquier secuencia de ADN en el genoma. Solo era cuestión de reemplazar el gen de la transposasa contenido en el elemento P por el ADN que querían insertar. De esta manera, demostraron como hacer moscas transgénicas mediante la inyección de embriones, con la técnica que ya describimos.
Los elementos transponibles fueron y son interesantes por sí mismos, ya que son elementos que pueden moverse por el genoma y causar mutaciones. ¿Cómo funcionan? ¿Cómo se mueven? ¿Pueden ser letales? ¿Cómo se regulan para que no sean letales? ¿Por qué están todavía en las moscas si pueden causar mutaciones nocivas? Son muchas preguntas que aún hoy siguen siendo estudiadas.
Esas preguntas resultaron además en una poderosa invención, la manera de poner cualquier gen de cualquier fuente dentro de la mosca, una herramienta que permitirió incontables descubrimientos posteriores y que revolucionó el uso de Drosophila como un organismo modelo.
¿Cómo continúa esta historia?
Más usos para los elementos transponibles. los "Enhancer traps".
En el post sobre moscas transgénicas, dijimos que parte del ADN que no contiene información para producir ARN o proteínas, contiene las instrucciones para situar la maquinaria que está a cargo de usar la información contenida en el ADN y producir ARN (la maquinaria de transcripción). Esas regiones están ubicadas alrededor del gen que controlan y se llaman promotores y potenciadores (enhancers).
Los promotores son los que contienen la información mínima para situar y armar la maquinaria de transcripción, mientras que los enhancers (prefiero el término en inglés, es poco usual traducirlo) son los que informan sobre el momento y el lugar donde debe ocurrir la expresión (llamamos expresión a la transcripción de un gen, la producción de ARN a partir del ADN).
Usamos como ejemplo ficticio la idea de generar copias de las instrucciones para la expresión de un gen y usarlas para indicar a la maquinaria de transcripción que produzca el ARN de una proteína fluorescente (GFP). De esta manera podíamos ver cuándo en el ciclo de vida y dónde en el cuerpo de la mosca se expresa normalmente el gen, con solo observar la fluorescencia con un microscopio.
Pero, ¿qué sucede si no sabemos qué genes están involucrados en el proceso biológico que nos interesa? ¿Cómo podemos descubrir esos genes?
A finales de la década de 1980, el laboratorio de Walter Gehring generó una herramienta para descubrir las regiones que contienen instrucciones para la expresión. Esta herramienta se llama enhancer trap (una trampa para enhancers) y utiliza los elementos P y la transposasa que mencionamos anteriormente de una manera muy creativa.
Construyeron un plásmido con los elementos P alrededor de un gen que permite producir una proteína que podría visualizarse. Llamemos a esto un reportero porque puede reportar o mostrar la expresión de otros genes. Hicieron una mosca transgénica que contenía este reportero.
Por otro lado, los laboratorios de Engels, Rubin y Spradling habían generado herramientas para provocar la movilización de los elementos P insertados (volveremos sobre esto con más detalle cuando hablemos de mutantes en el futuro). Esta herramienta específica es una mosca que tiene el gen de la transposasa inmovilizado en el genoma, incapaz de saltar de lugar.
Cruzaron estas dos líneas para tener una progenie que tuviese ambos elementos (¿se acuerdan de Mendel?), la transposasa y el reportero. Ahora, la transposasa puede cortar el ADN alrededor de los elementos P e insertarlo aleatoriamente en el genoma. El reportero estaba alrededor de elementos P, por lo que en la progenie de las moscas que tenían los dos elementos, el reportero se movería de su lugar original a una ubicación aleatoria en el genoma.
Las moscas producen muchos huevos y cada uno de esos descendientes tendría al reportero en un lugar diferente. Por cuestiones probabilísticas, una parte de esas inserciones aleatorias se debería encontrar junto a secuencias con instrucciones para la expresión de diferentes genes.
Visualizando posteriormente al reportero, descubrieron genes con patrones de expresión interesantes. Las moscas que generaron se conocen como líneas enhancer trap, porque el reportero insertado al azar se usó para atrapar los enhancers de genes.

Posteriormente en la historia, esta estrategia se modificó para usar GFP u otros genes como reporteros. Se produjeron enormes colecciones de este tipo de líneas, y de esta manera se descubrieron muchos genes interesantes.
Un uso interesante de estas líneas enhancer trap es poder observar los efectos que alteraciones en el ambiente de la mosca provocan sobre la expresión de un gen. Por ejemplo, cambios en la expresión de genes provocados por cambios en la alimentación de la mosca, o cuando se las expone a diferentes temperaturas, etc.
¿Qué más se les ocurre?
Al entenderse mejor cómo funcionan los enhancers, se encontró que se pueden usar porciones de las secuencias de los enhancers para indicar a la maquinaria que exprese un gen en lugares más específicos y acotados, a veces incluso en una o dos células puntuales. Existen enormes colecciones de estas líneas transgénicas para que cualquiera las use.
El sistema de expresión Gal4-UAS
¿Y si queremos inducir la expresión de algún gen?
En el post sobre moscas transgénicas, hablamos sobre colocar la secuencia con las instrucciones en un plásmido delante del gen que queremos expresar y luego crear una mosca transgénica. Pero ¿qué hacemos si queremos expresar ese mismo gen de otra manera? En ese caso tendríamos que hacer otra mosca transgénica con diferentes instrucciones. Y una nueva para cada expresión diferente que quisiésemos inducir. Eso tomaría mucho tiempo y no sería para nada práctico.
¿Entonces que hacemos? ¿Cómo evitar tener que crear una nueva transgénica para cada combinación?
La solución fue desarrollada a mediados de la década de 1990 por Andrea Brand y Norbert Perrimon. Tuvieron la brillante idea de separar los dos elementos del sistema y poner las secuencias con las instrucciones en una mosca y el gen que se va a expresar en otra. Cuando se cruzan esas moscas, la descendencia va a tener ambas partes del sistema y el gen se va a expresar (¡acuérdense siempre de Mendel!).
¿Pero cómo? ¿Cómo se conectan los dos elementos? ¿No dijimos que las instrucciones para expresar un gen deben estar al lado del gen?
La solución es usar un intermediario entre las dos partes, un adaptador. En este caso, las secuencias instructivas que sacamos de la mosca controlarán la expresión de un gen proveniente de levaduras, llamado Gal4. Este gen no existe en las moscas y codifica para producir un factor de transcripción.
Como dijimos anteriormente, los factores de transcripción son las proteínas que leen las instrucciones para provocar la transcripción (se unen a los promotores y enhancers) y activan la expresión de los genes. El factor de transcripción Gal4 reconoce secuencias con instrucciones llamadas UAS, que son específicas de levaduras y que tampoco existen en las moscas. Estas instrucciones provenientes de levadura se ponen delante del gen que queremos expresar.
Se podría lograr un control de la expresión un poco personalizable utilizando otro tipo de secuencia de control.
Existe una proteína llamada Heat Shock factor (factor de shock térmico), esta proteína se produce cuando la temperatura del organismo se eleva por encima de un nivel peligroso.
Esta proteína es parte de un mecanismo para proteger a las células de los efectos destructivos de las altas temperaturas.
Usando el enhancer del gen de heat shock, podemos provocar la expresión de cualquier otro gen con solo dar a la mosca una exposición corta a una temperatura elevada (37C – 98.6F es alto para una mosca, su temperatura óptima de vida es 25C – 77F).
De esta manera podemos controlar cuándo se expresará el gen a través de un pulso de calor. Sin embargo, no podemos controlar dónde se expresará en el cuerpo de la mosca porque está en cada célula de la mosca.
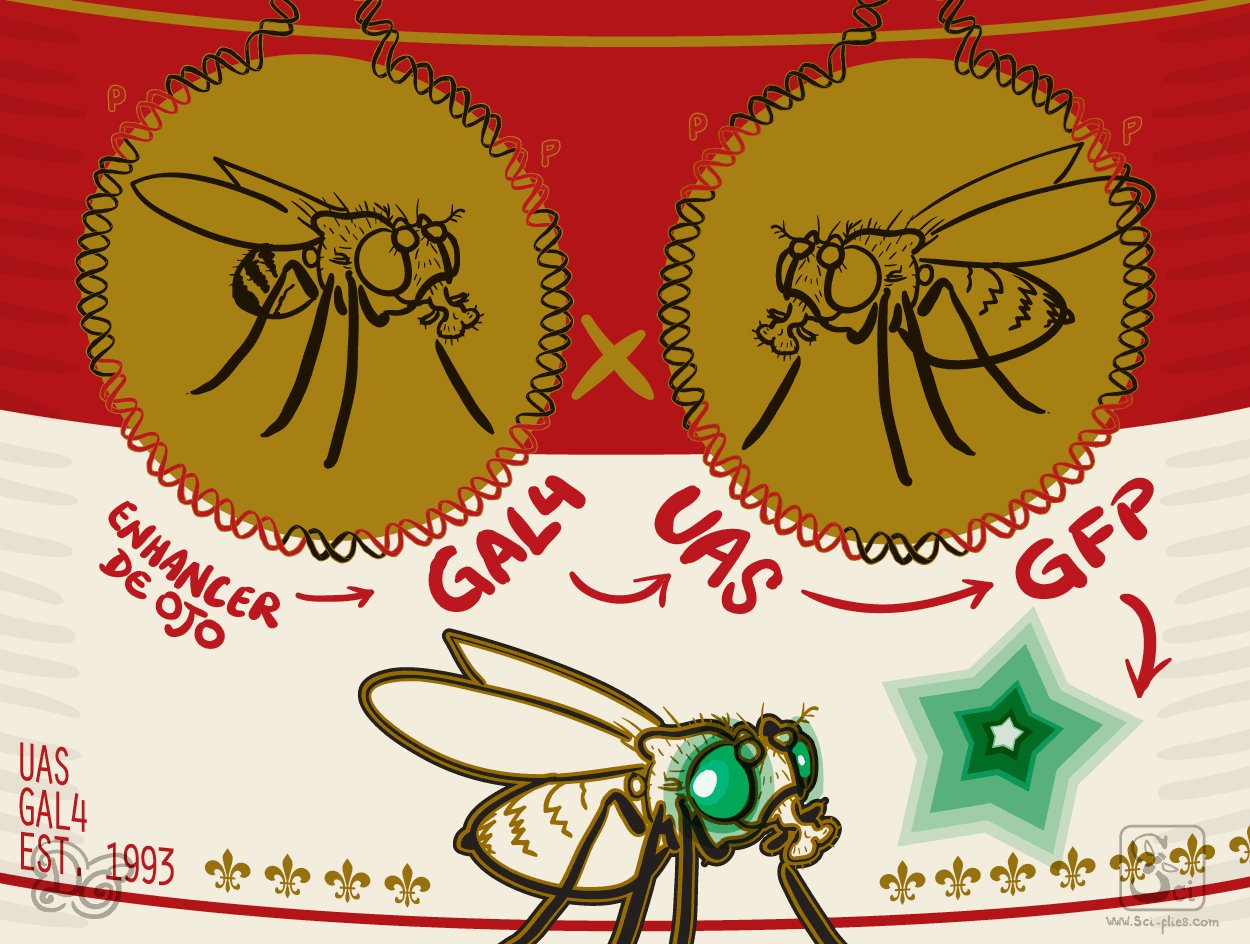
Ahora tenemos un sistema de dos partes. Una mosca Enhancer-Gal4 con instrucciones para producir Gal4 en un tiempo y lugar específicos y UAS-Gen de interés, que se activará solo cuándo y dónde esté presente Gal4. Las moscas Enhancer-Gal4 pueden cruzarse a moscas UAS-Gen de interés y producir descendientes que tienen ambos elementos.
Esto le dio una versatilidad increíble a la transgénesis en moscas. Además Brand y Perrimon utilizaron la estrategia de los enhancer traps para generar una colección de inserciones Gal4 aleatorias. Hicieron una mosca transgénica original con un gen Gal4 con elementos P en sus extremos y la cruzaron con la línea transposasa. En la descendencia, el gen Gal4 saltó a lugares aleatorios del genoma. Algunos lugares estaban cerca de enhancers que permitían inducir la producción de la proteína Gal4 en el patrón de expresión de genes desconocidos.
De repente, cualquier gen podría expresarse en cualquier lugar y en cualquier momento deseado. Se podría hacer moscas transgénicas UAS con genes reporteros (como GFP) o con genes con una función específica. O con genes de otras especies, o genes modificados a los que se les sacase partes o con codones modificados para producir proteínas alteradas y así analizar cómo se relaciona la función de la proteína con su estructura.
Por ejemplo, se hizo posible eliminar células específicas, expresando genes que inducen la muerte celular, y así ver qué sucede cuando esas células faltan. O expresar variantes de proteínas que funcionan como represores. O expresar genes de desarrollo en un lugar o tiempo diferente al normal para comprender mejor cómo se relacionan la función con el tiempo y el lugar de su expresión. Y así, muchas cosas más. Y seguro que vamos a mencionar muchas en el futuro..

La generación de estas herramientas desde principios de la década de los 80s hasta mediados de la década de los 90s constituyó una revolución en el uso de las moscas Drosophila como un organismo modelo genético muy maleable. La forma de pensar los experimentos cambió y las preguntas que podrían abordarse se expandieron. Se hizo posible diseccionar los componentes moleculares, genéticos y celulares de casi todos los aspectos de la biología de la mosca.
La descripción de los elementos transponibles en la mosca, llevó a la comprensión de sus mecanismos moleculares, lo que a su vez permitió su manipulación y su uso en nuevas técnicas. Constantemente se descubren y describen nuevos mecanismos moleculares, esto hace posible su manipulación y así continúa el desarrollo de nuevas herramientas. Seguiremos hablando sobre herramientas y técnicas interesantes en el futuro.
En el próximo post hablaremos sobre algunas estrategias para descubrir genes interesantes y un ejemplo histórico muy importante.
Gracias por leer y nos vemos pronto!
Interesting References
Basé la mayor parte del texto en los artículos originales de Rubin, Bingham, Kidwell; Rubin y Spradling; Bellen, O’Kane, Willson, Grossniklaus, Pearson y Gehring; Brand y Perrimon; y algunos otros. Me divertí mucho leyendo esos papeles. También en parte de una entrevista a Rubin (Dis. Model Mech. 2016, vol. 9 (4) pp 361-364). Además use un review reciente de Halles et al. sobre técnicas en Drosophila (Genetics, 2015 vol. 201 (3) pp 815-842) que recomiendo a todos los interesados en leer más sobre estos temas.











La verdad, me encantó. Y muy buenos los dibujos y sus colores que clarifican lo que contás (me hizo acordar cuando utilizaba la transposasa y aparecían moscas con unos ojos increíbles). Felicitaciones. (y qué laburo es hacer este blog!!) Saludos.
Gracias por el comentario! Me alegro que los disfruten, es un placer hacerlo!